
Identifier les éléments obtenus – On repère les éléments obtenus à la fin de la réaction. Le dioxyde de carbone et l’eau sont les éléments obtenus après la réaction.
- Les éléments présents en début de réaction sont les réactifs.
- Les éléments présents en fin de réaction sont les produits.
- Le méthane et le dioxygène sont les réactifs.
- Le dioxyde de carbone et l’eau sont les produits.
Quels sont les réactifs et les produits ?
Correction Question 1 : Lors d’une transformation chimique, les réactifs sont les substances qui disparaissent / sont consommées ( exemple le carbone et le dioxygène lors de la combustion du carbone) et les produits sont les substances qui apparaissent / sont formées (exemple le dioxyde de carbone lors de la combustion du carbone). Question 2 :
| Transformation chimique | Transformation physique |
| combustion du méthane | Fusion de l’eau |
| l’eau de chaux avec le dioxyde de carbone | Mélange de l’eau et du sucre |
Question 3 : Lors de la combustion complète du butane (gaz contenu dans les briquets), le butane réagit avec le dioxygène (contenu dans l’air) pour former de l’eau et du dioxyde de carbone. Les réactifs sont : le butane et le dioxygène. Les produits sont : l’eau et le dioxyde de carbone. Bilan chimique : butane + dioxygène —> eau + dioxyde de carbone. Question 4 : Lors du test de reconnaissance des ions cuivre, une transformation chimique a lieu.
On dit qu’il y a transformation chimique lorsque des réactifs disparaissent et que des produits se forment à la place. Les ions cuivre réagissent avec l’hydroxyde de sodium (soude) pour former de l’hydroxyde de cuivre (précipité bleu).
Les réactifs sont : les ions cuivre et l’hydroxyde de sodium. Le produit est : l ‘hydroxyde de cuivre. Bilan chimique : ions cuivre + hydroxyde de sodium —> hydroxyde de cuivre Question 5 : On remplit un bocal de dioxygène puis on réalise la combustion d’un morceau de carbone.
Le carbone brûle et disparaît totalement. Dans le bocal, on a alors un peu de dioxygène et du dioxyde de carbone. Cette transformation chimique s’est arrêtée lorsque tout le carbone a été consommé. Question 6 : Lors d’une transformation chimique, il y a conservation de la masse.
On fait réagir 10g de méthane avec 12g de dioxygène, il se forme alors 9g de dioxyde de carbone et de l’eau. La masse d’eau produite est de : 10 + 12 – 9 = 13g. Question 7 :
| Équilibrées | Non équilibrées | |
| C + O 2 → CO 2 | X | |
| CH 4 + 2O 2 → CO 2 + 2H 2 O | X | |
| 2O 2 +H 2 → 2H 2 O | X |
.
Quels sont les tests chimiques qui permettent d’identifier deux des produits formes ?
Les tests chimiques à connaître en début de classe de seconde –
- Test du dioxygène : du dioxygène pur enflamme un combustible incandescent
- Test du dihydrogène : une flamme provoque une combustion explosive dont la détonation possède un bruit caractéristique
- Test de l’eau (aussi appelé test au sulfate de cuivre anhydre): au contact de l’eau le sulfate de cuivre anhydre blanc forme du sulfate de cuivre hydraté bleuté.
- Test du dioxyde de carbone (aussi appelé test à l’eau de chaux): au contact du dioxyde de carbone l’eau de chaux se trouble
- Tests de reconnaissance d’ions : un réactif forme avec l’ ion recherché un précipité ayant une couleur caractéristique.
- Ion bromure
- Ion calcium
- Ion chlorure
- Ion cuivre
- Ion fer II
- Ion fer III
- Ion iodure
C’est quoi un réactif en physique ?
Substance qu’on utilise pour la réaction qu’elle produit au contact d’autres substances.
Comment savoir le type de réaction ?
Une réaction chimique peut appartenir à trois grandes catégories : les réactions d’élimination, les réactions d’addition et les réactions de substitution. Ces différentes catégories sont caractérisées par les ruptures et les formations de liaisons lors des réactions. Identifier le type de réaction chimique qui a lieu lors de la transformation suivante : 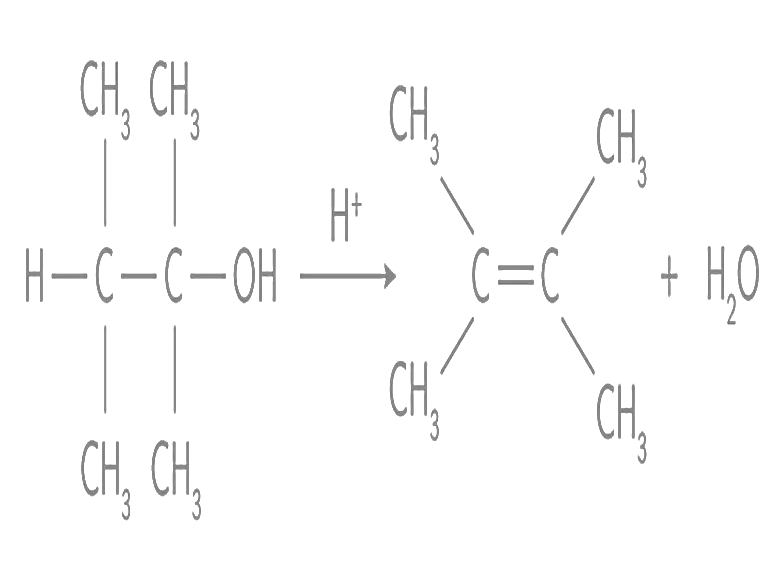 Etape 1.
Etape 1.
Quels sont les types de réactions ?
Quel sont les types de réaction ?
C’est quoi un réactif en SVT ?
réactif adj. Qui réagit, exerce une réaction vis-à-vis de quelque chose. réactif n. Substance qui peut réagir avec une ou plusieurs espèces chimiques. Courant réactif Réactif métallographique Schiff (réactif de). Solution aqueuse de fuchsine, décolorée par le bisulfite de sodium.
Qu’est-ce que c’est un produit en physique ?
Corps résultant d’une opération, d’une réaction.
Quels sont les réactifs et les produits de la combustion du méthane ?
Objectifs La production d’énergie passe par la combustion de matières premières comme le charbon et les hydrocarbures. Ces combustions engendrent des produits qui dépendent des matières premières utilisées. La combustion a. Définition Une combustion est une réaction chimique. Remarques : seules sont considérées ici les combustions dont le dioxygène est le comburant. Les hydrocarbures et le charbon sont de très bons combustibles. Combustion complète Quand il y a assez de dioxygène (réactif en excès), la combustion d’une matière première est complète. Elle produit du dioxyde de carbone et de l’eau (avec les hydrocarbures).
Les réactifs sont le combustible (corps qui brûle) et le comburant (corps qui aide à brûler). Le comburant est généralement le dioxygène. Cette réaction s’accompagne toujours d’un dégagement de chaleur (réaction exothermique).
Combustion incomplète Quand il n’y a pas assez de dioxygène, la combustion est dite incomplète. Elle risque de former du monoxyde de carbone, du carbone ou les deux à la fois. Rappel : le dioxygène de l’air est un comburant. Le diazote contenu dans l’air est un gaz inerte qui ne réagit ni n’intervient au cours de la réaction. Équation de la réaction : C + O 2 -> CO 2 b. Combustion du méthane La combustion complète du méthane (gaz de ville) produit du dioxyde de carbone et de l’eau. Équation de la réaction : CH 4 + 2 O 2 -> CO 2 + 2 H 2 O c. Combustion du propane La combustion complète du propane (gaz de chauffage ou domestique) produit aussi du dioxyde de carbone et de l’eau. Équation de la réaction : C 2 H 6 + 7/2 O 2 -> 2 CO 2 +3 H 2 O 3. Quelques combustions incomplètes a. Combustion incomplète du carbone La combustion incomplète du carbone peut produire (dans certaines conditions) du monoxyde de carbone selon l’équation suivante : Puis, le monoxyde de carbone produit réagit lui-même avec le dioxygène de l’air : b. Combustion incomplète du méthane La combustion incomplète du méthane produit du carbone ou du monoxyde de carbone et de l’eau. Équations possibles de la réaction : c. Combustion incomplète du propane La combustion incomplète du propane produit aussi du monoxyde de carbone ou du carbone et de l’eau : L’essentiel Une combustion est une réaction chimique exothermique mettant en jeu un combustible et un comburant (par exemple, les hydrocarbures avec le dioxygène de l’air). La combustion complète d’un hydrocarbure produit du dioxyde de carbone (CO 2 ) et de l’eau (H 2 O). La combustion incomplète d’un hydrocarbure risque de produire du monoxyde de carbone, ou du carbone, et de l’eau. Vous avez déjà mis une note à ce cours. Découvrez les autres cours offerts par Maxicours ! Découvrez Maxicours Comment as-tu trouvé ce cours ? Évalue ce cours !.
